搜索


近日🏌🏿,國際權威期刊Journal of the American Chemical Society(JACS)在線發表了題為“Glycan-Modified Cellular Nanosponges for Enhanced Treatment of Cholera Toxin-Induced Secretory Diarrhea”的研究論文,EON体育4平台博士生韓田振為第一作者,艾相昭長聘教軌副教授👩🏿⚕️、李榮秀教授和楊廣宇研究員為共同通訊作者🎁。

霍亂是一種由革蘭氏陰性霍亂弧菌引起的嚴重傳染病📕⛹🏿,全球每年約有300萬感染病例,患者通常在數小時內出現嚴重的分泌性腹瀉,導致低血壓休克和死亡🙇🏼♂️。霍亂弧菌根據其外膜脂多糖的O抗原可分為200多個血清群(O1- O200)🤳,因此具有非常復雜的病原多樣性。然而👩🏿🦱,目前的臨床方案仍然不足以有效治療霍亂感染🥿。例如🧏🏼♀️,口服補液是治療霍亂的標準方案,其通過補充大量液體和鹽分來緩解患者的嚴重脫水,但無法抑製霍亂弧菌的感染過程。抗生素能夠減輕霍亂弧菌引起的腹瀉症狀,但起效時間較晚且無法快速緩解脫水,同時抗生素大量使用也可能導致出現耐藥的超級霍亂菌株。霍亂疫苗有望預防霍亂弧菌的感染,但由於O抗原的多樣性,目前的霍亂疫苗預防效果均不理想,而開發多價廣譜的霍亂疫苗仍然存在巨大挑戰。因此⛈,亟待開發新策略來有效應對霍亂弧菌引起的霍亂疫情。
在霍亂弧菌定植小腸的過程中,會大量分泌一種外毒素蛋白👳🏽♀️💆🏽♂️,稱為霍亂毒素(cholera toxin),這是引起霍亂的主要毒力因子之一👨👩👦。霍亂毒素具有AB5型蛋白結構💇🏻,由一個A亞基和五個相同的B亞基組成。在感染過程中🧑🏻🎄,B亞基首先與小腸上皮細胞膜上多種糖萼受體結合⚾️,這是其感染宿主細胞最關鍵的第一步。內吞進入細胞後🤳®️,霍亂毒素通過逆行轉運途徑進入內質網管腔↘️,並將A亞基釋放在細胞質中🈂️👩❤️💋👨,其能夠通過ADP核糖基化來激活腺苷酸環化酶,提高細胞內環磷酸腺苷(cAMP)的濃度,從而過度激活小腸上皮細胞表面關鍵的陰離子通道蛋白(囊性纖維化跨膜傳導調節蛋白,CFTR)🤷🏻♂️。該過程最終導致大量氯離子(Cl-)過度分泌到腸腔內,引起腸液的電解質失衡,使大量水分從腸粘膜下層滲透到腸腔,最終造成嚴重的急性水樣腹瀉和危及生命的並發症。
受到霍亂毒素入侵宿主細胞過程的啟發,EON体育4平台設計了一種糖萼受體功能化的小腸上皮細胞膜仿生納米誘餌(Glyco-INS)✴️,用於口服治療霍亂毒素引起的分泌性腹瀉。首先,EON体育4平台提取小腸上皮細胞的細胞膜🚮,將其包覆在可生物降解的聚乳酸-羥基乙酸(PLGA)納米核心上,並在細胞膜表面嵌入糖脂分子(富含唾液酸的神經節苷脂)來構建Glyco-INS💂♀️,其尺寸約為160 nm🏀,且完整保留了小腸上皮細胞的所有膜蛋白成分。在霍亂毒素入侵宿主細胞實驗中📷,Glyco-INS能夠有效捕獲霍亂毒素(94%),從而抑製小腸上皮細胞內cAMP濃度的升高。同時🔻,EON体育4平台將一種強效CFTR抑製劑(PPQ-102, IC50 ~90 nM)裝載到Glyco-INS的PLGA核心中(Glyco-INS-P),通過胃腸道微環境響應的精準藥物控釋,有效阻斷霍亂毒素感染的宿主細胞內Cl-離子的過度外排👩🏻🦲,實現了“內外兼顧”的協同治療👩🏭。在霍亂毒素引起的小鼠腹瀉模型中🤹🏿,口服Glyco-INS-P能夠有效減少小鼠的腹瀉腸液體積、炎症因子表達和和腸道組織損傷,並恢復到健康小鼠的水平。更重要的是🪅,Glyco-INS天然繼承了宿主細胞膜上全部的靶蛋白和糖萼受體🧛🏻♂️,有望廣譜性中和多種具有復雜結構和致病機製的細菌外毒素,從而為治療不同致病菌引起的腹瀉相關疾病提供了廣譜應對方案,具有潛在的臨床應用前景。
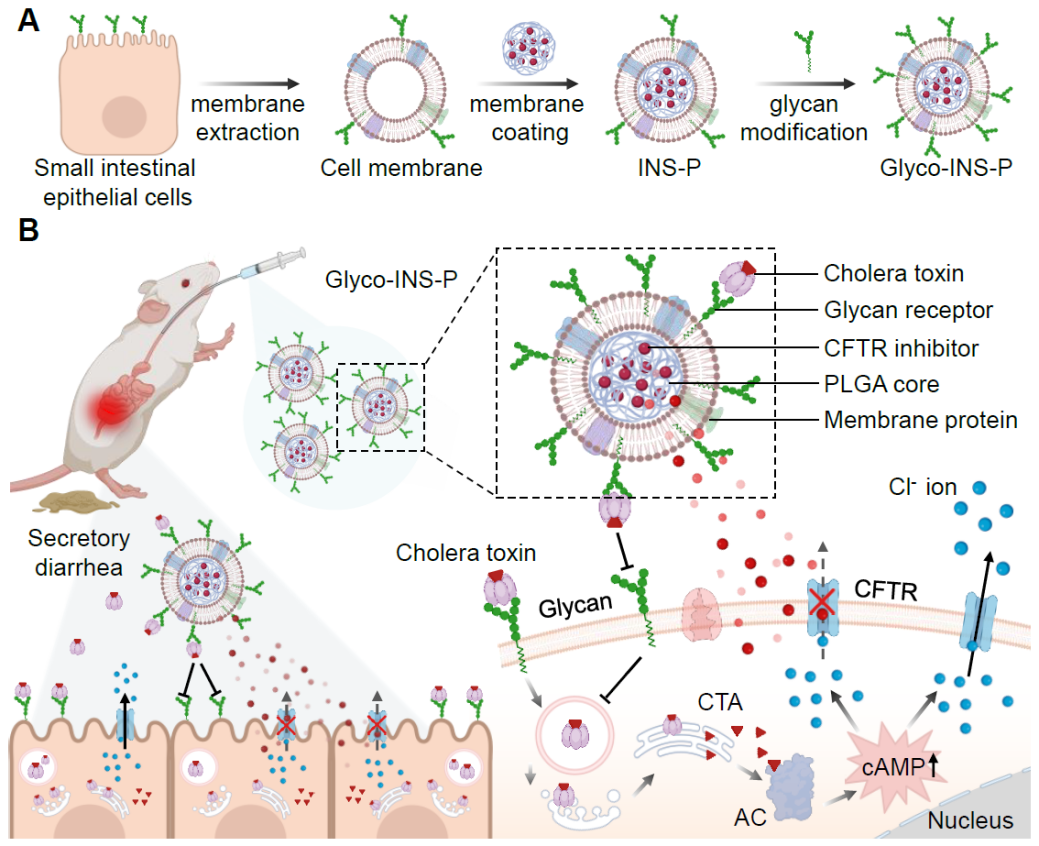
圖1.(A)糖萼功能化的小腸上皮細胞膜仿生納米藥物(Glyco-INS-P)製備過程示意圖🤷🏿♂️;
(B)口服Glyco-INS-P後在小鼠模型中有效治療霍亂毒素引起分泌性腹瀉的潛在機製🐷。
艾相昭課題組聚焦細胞膜仿生納米藥物遞送和腫瘤疫苗開發的研究領域🧑🏽🌾,取得了一系列研究成果🍗。該工作得到了國家自然科學基金(32271437、52202180🙍🏿♀️、32371483)和上海市科技重大專項的資助。
論文鏈接:https://pubs.acs.org/doi/full/10.1021/jacs.5c00955


 首頁
首頁

 EON4概況
EON4概況

 師資隊伍
師資隊伍

 人才培養
人才培養

 招生就業
招生就業

 科學研究
科學研究

 平臺基地
平臺基地

 黨群工作
黨群工作

 校友之家
校友之家

 安全工作
安全工作

 網上辦事
網上辦事

 當前位置🙎♀️🙍🏼♀️:
當前位置🙎♀️🙍🏼♀️: