搜索


日前,國際學術期刊Cell Discovery在線發表了EON体育4平台吳更教授團隊在mTOR信號通路的結構和功能機製方面的最新研究成果“Structural insight into the Ragulator complex which anchors mTORC1 to the lysosomal membrane”。
mTOR信號傳導通路是在單細胞真核生物(如酵母)🤬、植物(如擬南芥)📬🛀🏽、無脊椎動物(如果蠅)🥂、脊椎動物(如人)中非常保守的一條信號傳導通路,負責調節細胞的生長和增殖等重要生命過程。mTOR信號通路中重要基因的突變與多種人類疾病如癌症🔧、糖尿病等密切相關。Ragulator五元蛋白質復合物是mTOR信號通路中非常重要的一個復合物,它通過Lamtor1亞基定位在溶酶體的表面,並通過其所結合的RagA-RagC GTPase復合物招募mTORC1復合物到溶酶體表面,從而被Rheb蛋白所激活。
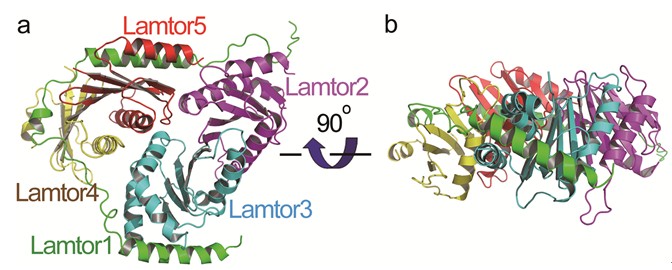
研究人員解析了人源Ragulator五元蛋白質復合物的晶體結構🧍🏻♀️,發現該復合物的Lamtor1亞基像一根皮帶一樣⏫,把其他四個亞基Lamtor2、Lamtor3、Lamtor4、Lamtor5裹在一起。揭示了Lamtor4和Lamtor5缺乏alpha3螺旋結構👵🏿,通過Lamtor1的兩段螺旋嵌在Lamtor4和Lamtor5上對應於Lamtor2和Lamtor3的alpha3螺旋的位置🦟,從而穩定了Lamtor2和Lamtor3的結構。研究還發現👨🏻🏫,酵母的Ego復合物僅對應於Ragulator的三個亞基(Lamtor1的C端、Lamtor2和Lamtor5)🧗,可能存在尚未發現的其他亞基🕡。
該成果是吳更教授團隊近年來發表的關於mTOR信號傳導通路的蛋白質復合物結構功能研究的第三篇論文🤙🏿。在前兩篇論文中🏊🏼♂️,吳更教授團隊報導了mTOR信號傳導通路中腫瘤抑製蛋白TSC1的C末端coiled coil與TBC1D7的復合物晶體結構,闡明了TBC1D7有著穩定TSC1的C末端coiled coil二聚化的重要作用(Gai et al., Journal of Molecular Cell Biology, 8:411-425, 2016);解析了mTOR信號傳導通路的精氨酸感應器CASTOR1與精氨酸的復合物結構,揭示了CASTOR1特異性識別精氨酸🦧,以及精氨酸誘導CASTOR1發生構象變化解除CASTOR1對下遊的GATOR2復合物的抑製的分子機理(Gai et al., Cell Discovery, 2:16051, 2016)🚽。


 首頁
首頁

 EON4概況
EON4概況

 師資隊伍
師資隊伍

 人才培養
人才培養

 招生就業
招生就業

 科學研究
科學研究

 平臺基地
平臺基地

 黨群工作
黨群工作

 校友之家
校友之家

 安全工作
安全工作

 網上辦事
網上辦事

 當前位置:
當前位置: