搜索


近日👩🏽🎨,微生物代謝國家重點實驗室馮雁課題組在美國生物化學與分子生物學學會會刊The Journal of Biological Chemistry上在線發表研究文章《Enhanced Enzyme Kinetic Stability by Increasing Rigidity within the Active Site》🌄🙅🏿♂️,建立了酶活性中心穩定化新策略🐃🧖🏼♀️,闡明了酶動力學穩定性提高的結構基礎。
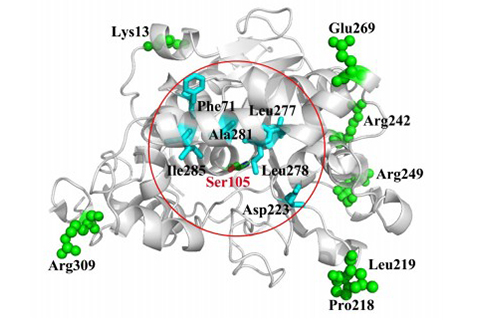

酶作為高效、環境友好的生物催化劑,在生物材料、醫藥🧑、能源等工業中具有重要應用,但由於天然酶的生物學穩定性低🥷,易失活✋🖱,極大地限製了現代生物產業的發展。探討酶穩定性機製、建立有效的酶穩定化策略已成為生物學和蛋白質工程中具有挑戰性的工作👔。馮雁教授課題組在多年研究的基礎上,提出了“酶活性中心穩定化”策略🤹🏼♂️🕵️♂️,即針對酶活性中心區域柔性較高🧜🏿♀️、構象易變的特點,通過定向結構修飾來提高其剛性,從而提高酶動力學穩定性🙍🏿♂️。他們以Candida antarctica脂肪酶為模式酶,圍繞催化活性殘基Ser附近高B因子殘基進行迭代飽和突變,通過對小型智能突變庫篩選🙇🏻♂️🏄♂️,獲得了既保持催化高活性,同時動力學穩定性明顯提高的突變體;進一步與吳更課題組合作製備突變體晶體結構發現✮,組成底物通道的α螺旋形成了新的主鏈間氫鍵網絡,增強了酶活性部位的剛性。這表明在保持酶活性中心原有骨架基礎上🧛🏻♀️,提高其內部二級結構穩定性是改善酶動力學穩定性的有效手段🕐。
該研究不僅提出了“酶活性中心穩定化”新策略,更重要的是從區域穩定化的角度揭示了酶活性中心剛性對酶動力學穩定性的影響🙉。“酶活性中心穩定化”策略有望為生物催化提供高穩定性新酶源,還可能為合成生物學設計、定製新型生物元件提供指導🖐🏼😮。該研究得到了國家重點基礎研究發展計劃項目(2012CB721003、2011CBA00800),國家自然科學基金項目(31370106)🦹🏽♂️,以及“863”項目(2013AA102801)的支持😠。
文章鏈接:(http://www.jbc.org/content/early/2014/01/21/jbc.M113.536045. full.html#ref-list-1)


 首頁
首頁

 EON4概況
EON4概況

 師資隊伍
師資隊伍

 人才培養
人才培養

 招生就業
招生就業

 科學研究
科學研究

 平臺基地
平臺基地

 黨群工作
黨群工作

 校友之家
校友之家

 安全工作
安全工作

 網上辦事
網上辦事

 當前位置:
當前位置: