搜索


近日🗃,分子生物學知名刊物《Nucleic Acids Research》和微生物學經典刊物《Molecular Microbiology》先後發表了EON体育4平台、微生物代謝國家重點實驗室鄧子新團隊歐竑宇研究組關於細菌毒素-抗毒素系統的生物信息學和實驗研究的兩篇論文🦶🏽😦,進一步闡明肺炎克雷伯菌中耐藥基因水平轉移和持留態細胞形成的分子機製⛑️。
由於抗菌藥物的不合理使用,細菌耐藥性急速加劇💈。碳青黴烯類藥物抗性在肺炎克雷伯菌等革蘭陰性條件致病菌中的快速播散💆🏿♀️,更是成為全球面臨的最嚴重公共衛生問題之一。質粒、整合性接合元件🙎🏽🏈、轉座子等可移動遺傳元件是介導耐藥和致病基因水平轉移的主要載體🙎🏿♀️。細菌的毒素-抗毒素系統 (toxin-antitoxin sytem, TA) 與這些移動元件的遺傳穩定性密切相關©️,是影響耐藥性擴散的重要因素🐾。TA系統由穩定的毒素蛋白和不穩定的抗毒素蛋白(或RNA)組成🐖🚰,它們是由一個操縱子中兩個結構基因編碼的。毒素蛋白對細菌生長具有致死或抑製作用🕒,而抗毒素蛋白能中和毒素的毒性。
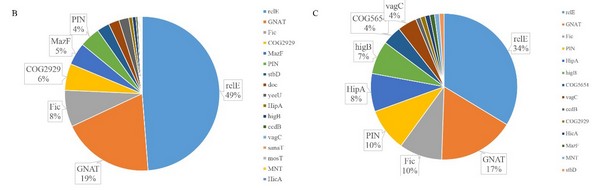
歐竑宇研究組通過文本實體識別和語義提取,廣泛地收集了散布於文獻和公共數據庫的異質數據,梳理了一百多對經實驗驗證的和近六千對潛在的TA系統,定義和審編了基因座位、操縱子結構、家族歸類、毒素作用靶位點、宿主菌和實驗文獻等等基本數據項,更新了基於web的開放數據庫TADB。此外,采用隱馬爾可夫模型搜索保守域和操縱子結構識別相結合的算法,開發了在線工具TAfinder用於預測II 型TA系統🏣。TAfinder對兩千多個細菌的全基因組序列進行掃描後,發現了乙酰基轉移酶類RHH-GNAT家族的TA系統廣泛分布於腸道沙門菌和肺炎克雷伯菌的染色體上♡,僅次於目前研究的最深入的RelBE家族。相關研究論文“TADB 2.0: an updated database of bacterial type II toxin-antitoxin loci”發表在《Nucleic Acids Research》上,謝英洲、衛以青和申閱同學為共同第一作者,歐竑宇教授為通訊作者🌮。
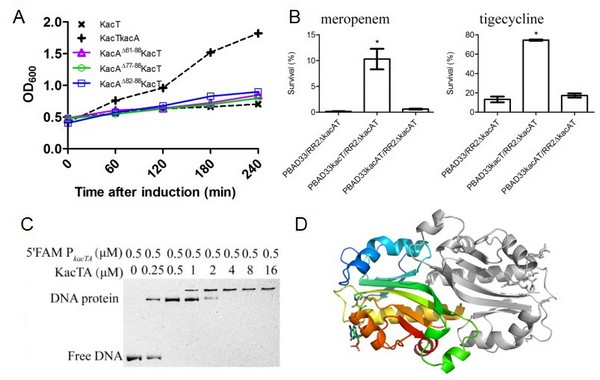
歐竑宇研究組進而以在碳青黴烯類耐藥肺炎克雷伯菌HS11286中預測到的乙酰基轉移酶類RHH-GNAT TA系統KacAT為研究模型,開展實驗驗證工作。近期,在腸道沙門菌和致病大腸桿菌中已分別報道了GNAT毒素蛋白通過乙酰化tRNA攜帶的氨基酸以阻遏蛋白質的正常翻譯;但RHH抗毒素蛋白中和GNAT毒素毒性的分子機製還未闡明𓀏。研究人員和復旦大學生命科學EON4甘建華教授研究組開展合作👨🏻🦰🌍,解析了GNAT毒素蛋白KacT晶體結構👬🏻,發現KacT以二聚體形式發揮乙酰基轉移酶的功能🥲。生理和生化實驗表明,RHH抗毒素蛋白KacA在胞內和毒素KacT共表達時,形成KacA4KacT2異源六聚體復合物以抑製毒素形成功能性的二聚體🤾🏽♀️。此外,KacAT復合物特異地結合到kacAT操縱子的啟動子區,在轉錄水平實現KacAT操縱子的反饋抑製。抗毒素KacA的C-端結合毒素蛋白KacT;而N-端結合DNA。在高濃度碳青黴烯等抗菌藥物壓力下🧩,GNAT毒素蛋白KacT的過表達促進肺炎克雷伯菌形成持留態細胞,提高病原細菌對抗菌藥物的耐受性💿。相關工作入選了2017年全國環境微生物學學術研討會的大會報告;研究論文“Identification and characterization of acetyltransferase-type toxin-antitoxin loci inKlebsiella pneumoniae”發表在《Molecular Microbiology》上🤹🏼♂️,錢宏亮同學為第一作者,歐竑宇教授和復旦大學生命科學EON4甘建華教授為共同通訊作者💑。
鄧子新團隊的歐竑宇研究組長期從事耐藥病原細菌的可移動基因組研究♚。以上兩篇論文是繼該研究組發現了碳青黴烯酶基因blaKPC-2借助Tn1721-Tn3復合轉座子在ST11型肺炎克雷伯菌中擴散(Journal of Antimicrobial Chemotherapy,2015)、亞抑製濃度β-內酰胺藥物增強肺炎克雷伯菌六型分泌系統的菌間拮抗作用(Frontiers in Cellular and Infection Microbiology🧤,2017)、攜帶第三代頭孢菌素抗性基因blaDHA-1的耐藥質粒可在肺炎克雷伯ST23型高毒株中接合轉移(Virulence,2018)以來🧜🏻,在肺炎克雷伯菌耐藥性擴散的研究上的系統性進展。研究工作獲得了國家自然科學基金和973項目的資助🧓🏽。


 首頁
首頁

 EON4概況
EON4概況

 師資隊伍
師資隊伍

 人才培養
人才培養

 招生就業
招生就業

 科學研究
科學研究

 平臺基地
平臺基地

 黨群工作
黨群工作

 校友之家
校友之家

 安全工作
安全工作

 網上辦事
網上辦事

 當前位置:
當前位置: